問題
最大出力600〔MW〕の重油専焼火力発電所がある。
重油の発熱量は44000〔kj/kg〕で、潜熱は無視するものとして、
次の(a)及び(b)に答えよ。
(a)45000〔MW・h〕の電力量を発生するために、消費された重油の量が $9.3\ \times\ 10^3$ 〔t〕であるときの発電端効率〔%〕の値として、最も近いものは次のうちどれか?
(1)37.8
(2)38.7
(3)39.6
(4)40.5
(5)41.4
(b)最大出力で24時間運転した場合の発電端効率が40.0〔%〕であるとき、発生する二酸化炭素の量として、最も近い値は次のうちどれか?
なお、重油の化学成分は重量比で炭素85.0〔%〕、水素15.0〔%〕、
原子量は炭素12、酸素16とする。
炭素の酸化反応は次のとおりである。
$\ C\ \times\ O_2\ \rightarrow\ CO_2$
(1) $3.83\ \times\ 10^2$
(2) $6.83\ \times\ 10^2$
(3) $8.03\ \times\ 10^2$
(4) $9.18\ \times\ 10^3$
(5) $1.08\ \times\ 10^4$
基礎知識
(a)まずは、発電端効率は効率であるので、入力エネルギーに対する出力エネルギーの比です。
問題には、入力エネルギーがジュール〔j〕であり、出力エネルギーがワット〔W〕で出ています。
すると、ジュール〔j〕とワット〔W〕の関係が問題になってきます。
そこで、「1〔W〕で1〔秒間〕に発生する熱量が1〔j〕である。」(1〔W・S〕=1〔j〕)を覚えておきましょう。
すると、1〔W・h〕は1〔W〕で1時間に発生する熱量なので、60〔秒〕×60〔分〕=3600〔秒〕から、1〔W・h〕=3600〔j〕となります。
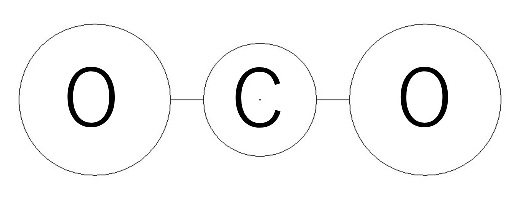
(b)二酸化炭素($\ CO_2\ $)は、炭素 $C$ が1つに酸素 $O$ が2つで構成されています。
次に、原子量という言葉の説明ですが、炭素原子を1〔mol(モル)〕分集めると12〔g〕になるので炭素の原子量を12として、これを基準にし他の原子又は分子の質量を比で表したものです。
すると、酸素原子を1〔mol〕分集めると16〔g〕になります。
同様に、二酸化炭素分子を1〔mol〕分集めると、$12+16\times2=44$ より44〔g〕になります。
解答
(a)は(3)が正解。
まずは、入力エネルギーは消費された重油の量に発熱量を掛けると求まります。(単位に注意してください)
入力エネルギー$=9.3\times10^3\times10^3(kg)\times44000(kj/kg)=4092\times10^8(kj)$
出力エネルギーは、発生電力量をキロジュール〔kj〕に変換して求めます。
出力エネルギー$=45000\times10^3(kW\cdot h)\times3600(h/s)=1620\times10^8(kj)$
${発電効率}=\cfrac{入力エネルギー}{出力エネルギー}$ より
$\cfrac{1620\times10^8}{4092\times10^8}=0.395894\fallingdotseq39.6(\%)$ になります。
(b)は(4)が正解。
まずは、最大出力で24時間運転した時の出力エネルギーを求めましょう。
最大出力で24時間運転すると、$600\times10^3(kW)\times24(h)=14400\times10^3(kW\cdot h)$ を出力します。
これをキロジュール〔kj〕に変換すると、$14400\times10^3(kW\cdot h)\times3600(h/s)=51840\times10^6(kj)$ となります。
発電端効率が40%なので、${発電端効率}=\cfrac{出力エネルギー}{入力エネルギー}$ より、
$0.4=\cfrac{51840\times10^6}{入力エネルギー}$ と書けます。
式変形して、${入力エネルギー}=\cfrac{51840\times10^6}{0.4}=129600\times10^6(kj)$ となります。
次に、この入力エネルギーを生み出す重油の量を求めます。
${出力エネルギー}={重油の量}\times{発熱量}$ より
$129600\times10^6={重油の量}\times44000$ と書けます。
式変形して、${重油の量}=\cfrac{129600\times10^6(kj)}{44000(kj/kg)}\fallingdotseq2945.45\times10^3(kg)$ となります。
この重油の内、炭素の質量は重量比で85.0〔%〕なので、
$2945.45\times10^3(kg)\times0.85=2503.6325\times10^3(kg)\fallingdotseq2504\times10^3(kg)$ になります。
炭素 $2504\times10^3$ 〔kg〕を酸化させるのに必要な酸素の質量は、原子量が12なので、12で割って、
$\cfrac{2504\times10^3}{12}=208.667\times10^3(kmol)$ より、
炭素は $208.667\times10^3$〔キロモル(kmol)〕あることになります。
炭素1〔mol〕に対して酸素2〔mol〕必要ですので、
原子量が16の必要な酸素の質量は、$208.667\times10^3\times16\times2=6677.34\times10^3(kg)$ となります。
二酸化炭素は、炭素と酸素の質量の合計ですから、$2504\times10^3+6677.34\times10^3=9181.34\times10^3$ 〔kg〕になります。
問題は、〔t〕で解答を求めているので、$9.18\times10^3$ 〔t〕となります。
まとめ
(a)の問題は、素直な問題ですから単位(キロ「k」とかメガ「M」とか)に注意をして解いてください。
「1〔W〕1〔秒〕で1〔j〕」を覚えておけばなんとかなります。
(b)は、頭を整理してかからないと解けません。
私なら、この問題は「パス」します。
時間がもったいないですから。
おまけ
1〔mol〕を少し説明しておきます。
1〔mol〕とは、原子を $6.02214076\times10^{23}$ 個集めたものです。
炭素(C)1〔mol〕の質量が12〔g〕になります。
また、酸素($O_2$) 1〔mol〕 の質量は32〔g〕になります。
炭素($C$)1〔mol〕と酸素($O_2$)1〔mol〕を合体させると、二酸化炭素($CO_2$)1〔mol〕ができます。
コメント